Vincristine Sulfate for Injection
Vinkristin Sulfat untuk Injeksi adalah campuran steril vinkristin sulfat dalam pembawa yang sesuai. Mengandung Vinkristin Sulfat, C46H56N4O10.H2SO4, tidak kurang dari 90,0% dan tidak lebih dari 110,0% dari jumlah yang tertera pada etiket. [Catatan Hati-hati dalam penanganan injeksi vinkristin sulfat, karena berpotensi sitotoksik]
Baku pembanding Vinkristin Sulfat BPFI, Vinkristin Sulfat BPFI (untuk penetapan kadar); Simpan ampul yang belum dibuka di tempat dingin. Setelah ampul dibuka, diamkan selama 30 menit untuk disamakan dengan kelembapan ruang sebelum ditimbang. Panaskan zat dengan cara Analisis Termogravimetri seperti tertera pada Analisis Termal <741>, mengunakan 10 mg zat, pada suhu antara suhu ruang dan 200°, kenaikan suhu 5° per menit dengan aliran gas nitrogen P 40 mL per menit. Dari termogram yang diperoleh, tetapkan jumlah susut bobot antara suhu ruang dan satu titik pada plato sebelum terjadi penguraian (pada suhu lebih kurang 160º). Simpan dalam wadah tertutup rapat, terlindung cahaya, ditempat dingin. Vinblastin Sulfat BPFI; [Catatan Tidak diperlukan penetapan susut pengeringan.]. Endotoksin BPFI; [Catatan Bersifat pirogenik, penanganan vial dan isi harus hati-hati untuk menghindari kontaminasi]. Rekonstitusi seluruh isi, simpan larutan dalam lemari pendingin dan gunakan dalam waktu 14 hari. Simpan vial yang belum dibuka dalam lemari pembeku.
Identifikasi
A. Lakukan penetapan seperti tertera pada Identifikasi secara kromatografi lapis tipis <281>.
Fase gerak, Penjerap, Penampak bercak Lakukan seperti tertera pada Identifikasi dalam Injeksi Vinkristin Sulfat.
Larutan baku Buat larutan Vinkristin Sulfat BPFI dengan kadar 10 mg per mL dalam campuran diklormetan P dan metanol P (3:1).
Larutan uji Timbang sejumlah serbuk untuk injeksi, larutkan dan encerkan dengan air hingga kadar setara dengan 10 mg per mL.
Prosedur Lakukan seperti tertera pada Identifikasi dalam Injeksi Vinkristin Sulfat: harga Rf bercak utama Larutan uji sesuai dengan Larutan baku.
B. Waktu retensi puncak utama kromatogram Larutan uji sesuai dengan Larutan baku yang diperoleh pada Penetapan kadar.
Larutan konstitusi Pada saat digunakan, larutan memenuhi syarat Larutan terkonstitusi seperti tertera pada Injeksi.
Endotoksin bakteri <201> Tidak lebih dari 100,0 unit Endotoksin FI per mg vinkristin sulfat.
Sterilitas <71> Memenuhi syarat.
Syarat lain Memenuhi syarat seperti tertera pada Injeksi.
Keseragamaan sediaan <911> Memenuhi syarat.
Prosedur untuk keseragamaan kandungan
Dapar Timbang 6,3 g amonium format P masukkan ke dalam labu tentukur 1000 mL, larutkan dalam lebih kurang 900 mL air. Atur pH hingga 5,0 dengan penambahan asam format P, sambil dikocok dan encerkan dengan air sampai tanda.
Larutan baku Buat secara kuantitatif larutan Vinkristin Sulfat BPFI dengan kadar lebih kurang antara 40 dan 50 µg per mL dalam Dapar.
Larutan uji Keluarkan isi satu wadah vinkristin sulfat untuk injeksi dalam wadah yang sesuai, larutkan dan encerkan dengan Dapar hingga diperoleh kadar vinkristin sulfat lebih kurang antara 40 dan 50 µg per mL.
Prosedur Ukur serapan Larutan baku dan Larutan uji pada panjang gelombang serapan maksimum 262 nm, terhadap Dapar sebagai blangko. Hitung jumlah dalam mg vinkristin sulfat, C46H56N4O10.H2SO4, tiap satu wadah serbuk untuk injeksi dengan rumus:
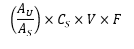
AU dan AS berturut-turut adalah serapan Larutan uji dan Larutan baku; CS adalah kadar Vinkristin Sulfat BPFI dalam µg per mL Larutan baku; V adalah volume akhir Larutan uji; F adalah faktor unit konversi, 0,001 mg per µg.
Cemaran organik Masing-masing cemaran tidak lebih dari 2,0% dan total cemaran tidak lebih dari 5,0%. Lakukan penetapan dengan cara Kromatografi cair kinerja tinggi seperti tertera pada Kromatografi <931>.
Larutan A, Larutan B, Fase gerak dan Sistem kromatografi Lakukan seperti tertera pada Cemaran Organik dalam Injeksi Vinkristin Sulfat.
Larutan uji A Timbang saksama sejumlah serbuk untuk injeksi, larutkan dan encerkan dengan air hingga kadar 1 mg per mL.
Larutan uji B Encerkan Larutan uji A dalam air hingga kadar 0,04 mg per mL.
Prosedur Suntikkan secara terpisah sejumlah volume sama (lebih kurang 200 mL) Larutan uji A dan Larutan uji B ke dalam kromatograf, rekam kromatogram dan ukur semua respons puncak. Hitung persentase tiap cemaran dalam serbuk untuk injeksi yang digunakan dengan rumus:
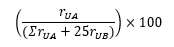
rUA adalah respons puncak dari masing-masing cemaran yang muncul sesudah puncak pelarut dari Larutan uji A dan rUB adalah respons puncak vinkristin dari Larutan uji B.
Hitung persentase total cemaran dalam serbuk untuk injeksi yang digunakan dengan rumus:
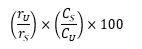
rUA adalah respons puncak dari masing-masing cemaran yang muncul sesudah puncak pelarut dari Larutan uji A dan rUB adalah respons puncak vinkristin dari Larutan uji B.
Penetapan kadar Lakukan penetapan dengan cara Kromatografi cair kinerja tinggi seperti tertera pada Kromatografi <931>.
Larutan A, Fase gerak, Larutan baku, Larutan kesesuaian sistem dan Sistem kromatografi Lakukan seperti tertera pada Penetapan kadar dalam Injeksi Vinkristin Sulfat.
Prosedur Suntikkan secara terpisah sejumlah volume sama (lebih kurang 10 µL) Larutan baku dan Larutan uji ke dalam kromatograf, rekam kromatogram dan ukur respons puncak utama. Hitung persentase vinkristin sulfat, C46H56N4O10.H2SO4, dalam serbuk untuk injeksi dengan rumus:
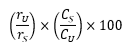
rU dan rS berturut-turut adalah respons puncak vinkristin dari Larutan uji dan Larutan baku; CS adalah kadar Vinkristin Sulfat BPFI dalam mg per mL Larutan baku; CU adalah kadar vinkristin sulfat dalam mg per mL Larutan uji berdasarkan jumlah yang tertera pada etiket.
Wadah dan penyimpanan Lakukan seperti tertera pada Wadah padatan steril dalam Injeksi. Simpan dalam lemari pendingin.
Penandaan Pada etiket tercantum: “Hanya digunakan untuk intravena, fatal jika digunakan dengan rute lain”.
Jika mengandung lebih dari 2 mg, harus dicantumkan sebagai kemasan ruahan farmasi seperti tertera pada Injeksi. Pada etiket dicantumkan bahwa obat hanya diberikan dalam wadah yang disertakan dalam kemasan. Jika dikemas dalam kemasan ruahan farmasi tidak berlaku persyaratan Injeksi bahwa injeksi yang telah dikonstitusi hanya dapat dipenetrasi sekali dengan alat steril yang sesuai karena telah mengandung zat atau campuran yang sesuai untuk mencegah pertumbuhan mikroba.
Jika untuk dispensing, wadah atau siring (disertakan dalam tiap kemasan untuk diberikan kepada pasien) dicantumkan penandaan pada kemasan: “Tutup tidak boleh dibuka sampai pada saat injeksi diberikan.”
